Die chronisch obstruktive Lungenerkrankung (COPD) ist eine Lungenerkrankung, die durch eine fortschreitende, weitestgehend irreversible Atemwegsobstruktion Atemwegsobstruktion Atemwegsobstruktion charakterisiert ist. Die Krankheit tritt meist bei Patient*innen mittleren bis höheren Alters auf und geht oft mit Nikotinabusus oder der Inhalation anderer Noxen einher. Symptome sind beispielsweise eine progressive Dyspnoe Dyspnoe Dyspnoe (Atemnot/Luftnot) und chronischer Husten und im Verlauf kann es zu Exazerbationen kommen. Bei der körperlichen Untersuchung können ein verlängertes Exspirium, ein Pfeifen und/oder ein abgeschwächtes Atemgeräusch festgestellt werden. Die Diagnose wird durch einen Lungenfunktionstest Lungenfunktionstest Lungenfunktionstests bestätigt. Die Behandlung umfasst im Idealfall eine Raucherentwöhnung, Lungenrehabilitation und Pharmakotherapie. Letztere richtet sich nach einem Stufenplan je nach Schweregrad der Krankheit.
Kostenloser
Download
Lernleitfaden
Medizin ➜
Die Chronisch obstruktive Lungenerkrankung (COPD) ist eine Erkrankung, bei der eine persistierende und i.d.R. progrediente Atemwegsobstruktion Atemwegsobstruktion Atemwegsobstruktion vorliegt. Sie geht mit einer gesteigerten Entzündungsreaktion der Atemwege einher, die durch Inhalation von Partikeln über lange Zeit bedingt ist. Der Atemwegsobstruktion Atemwegsobstruktion Atemwegsobstruktion liegt zum Einen eine Entzündung Entzündung Entzündung der kleinen Atemwege (obstruktive Bronchiolitis) und zum anderen eine Destruktion des Lungengewebes (Emphysem) zugrunde.
Patient*innen mit verschiedenen Subtypen können unterschiedliche Symptome und unterschiedliches Therapieansprechen aufweisen. Patient*innen können eine beliebige Kombination beider Subtypen aufweisen.
Inhalative Wirkstoffe verursachen eine chronische Entzündung Entzündung Entzündung der Atemwege, die zu einer fortschreitenden Atemwegsobstruktion Atemwegsobstruktion Atemwegsobstruktion führt.

Pathophysiologie der chronischen Bronchitis:
Entzündungen, Hypertrophie der glatten Muskulatur und übermäßige Schleimproduktion führen zu einer fortschreitenden Obstruktion der Atemwege.
Physiologisch besteht in der Lunge Lunge Lunge: Anatomie ein Gleichgewicht aus:
Bei einem Emphysem:
Morphologische Muster:
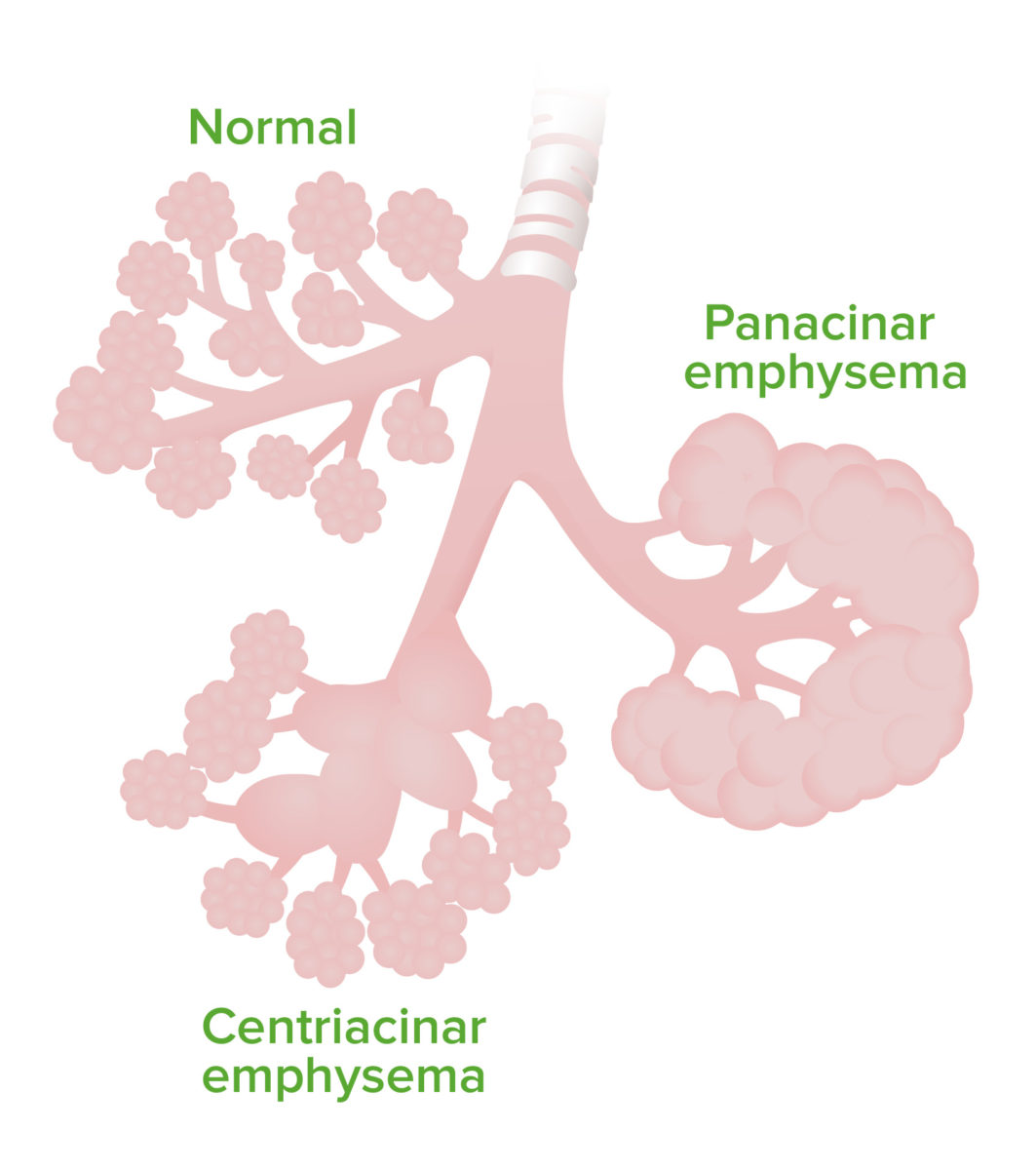
Emphysem:
Das Bild zeigt den Unterschied in den betroffenen Bereichen eines zentroacinären Emphysems gegenüber eines panacinären Emphysems.

Histopathologie eines schweren Emphysems mit vergrößerten Alveolen (weiße Räume)
Bild : „Histopathology of emphysem“ von Mikael Häggström, MD Lizenz: Public DomainDie Patient*innen leiden unter chronisch fortschreitenden Symptomen mit oder ohne akute Exazerbationen.
Allgemein:
Akute Exazerbation:
Bei Verdacht auf COPD sollte bei der körperlichen Untersuchung auf die folgenden Befunde geachtet werden:
Vitalwerte:
Allgemein:
Lungen:
Extremitäten:
Befunde, die auf ein Cor pulmonale Cor Pulmonale Cor Pulmonale hinweisen:

Fassthoraxwie bei Emphysem:
Man Beachte die Zunahme des anteroposterioren Thoraxdurchmessers.

Klinische Anzeichen einer Hypoxämie:
A: Zyanose
B: Trommelschlägelfinger
Anzeichen und Symptome werden häufiger entweder mit einer chronischen Bronchitis oder einem Emphysem in Verbindung gebracht. Patient*innen präsentieren sich jedoch häufig mit einer Mischung aus beidem.
Chronische Bronchitis („Blue Bloater“):
Emphysem („Pink Puffer“):

Das Bild zeigt die gespitzte Lippenatmung, die bei einem Emphysem auftreten kann.
Bild: „Pursed lip breathing.“ von O. Chaigasame. Lizenz: CC BY 4.0Die Diagnose richtet sich nach Anamnese, Symptomatik und Lungenfunktionsprüfung und wird durch den Nachweis einer nicht reversiblen Obstruktion gesichert.
Lungenfunktionstests werden angewendet, um die COPD-Diagnose zu bestätigen.
Spirometrie Spirometrie Lungenfunktionstests:
Reversibilitätstestung:
CO-Diffusionskapazität (DLCO)

Fluss-Volumen-Kurve bei COPD:
Beide Kurven sind aufgrund der Obstruktion reduziert. Ein dynamischer Atemwegskollaps verursacht einen schnellen Abfall des exspiratorischen Flusses, was zu einer konkaven Kontur führt. Das Residualvolumen erhöht sich aufgrund des Lufteinschlusses, wodurch sich die Kurve nach links verschiebt.
Zusätzlich zur COPD-Diagnose können Spirometrie-Ergebnisse in Verbindung mit den Symptomen verwendet werden, um den Schweregrad festzustellen Die Kriterien der Globalen Initiative GOLD (englisches Akronym: Global Initiative for Chronic Obstructive Lung Disease, GOLD) lauten wie folgt:
| GOLD-Klasse | Schweregrad der COPD | Symptome | Spirometrie-Ergebnisse |
|---|---|---|---|
| GOLD I | Leicht | keine bis mild |
|
| GOLD II | mittelgradig | Bei Belastung |
|
| GOLD III | schwer | Bei minimaler Belastung |
|
| GOLD IV | Sehr schwer | Im Ruhezustand |
|
Gruppe A:
Gruppe B:
Gruppe C:
Gruppe D:
Laborwerte:

Röntgenthorax eines 81-jährigen Mannes mit chronisch obstruktiver Lungenerkrankung (COPD) und begleitender Lungenentzündung
Bild: „
Röntgen-Thorax eines 81-jährigen Mannes mit chronisch obstruktiver Lungenerkrankung (COPD), der sich hauptsächlich mit produktivem Husten präsentiert:
Man beachte die erweiterten Interkostalräume, das abgeflachte Zwerchfell und die Verschattung im unteren, rechten Oberlappen, was auf eine begleitende Pneumonie hindeutet.
Jede Pharmakotherapie sollte individuell abgestimmt sein, jeweils abhängig von Symptomatik, Exazerbationsrisiko, Komorbiditäten und Compliance.